Pengertian, Cara Baca, Golongan, Periode, Unsur Utama dan Transisi Tabel Periodik
Pengertian Sistem Periodik Unsur
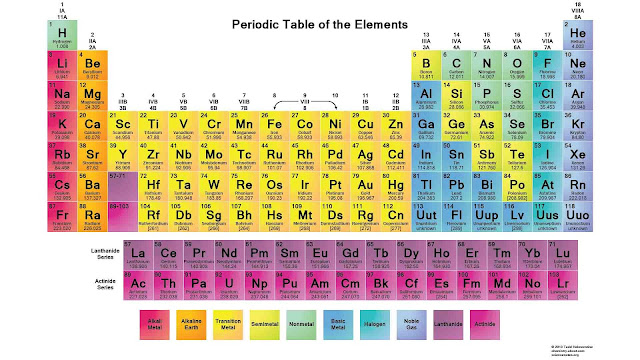
Sistem Periodik Modern atau sering disebut dengan Tabel Periodik Unsur adalah daftar susunan unsur-unsur kimia berdasarkan kenaikan nomor atom dan kemiripan sifat. Terdiri atas lajur horizontal dan lajur vertikal. Lajur horizontal disebut periode, disusun menurut kenaikan nomor atom sedangkan lajur vertikal disebut golongan, disusun menurut kemiripan sifat unsur.
Cara Membaca Tabel Periodik Unsur
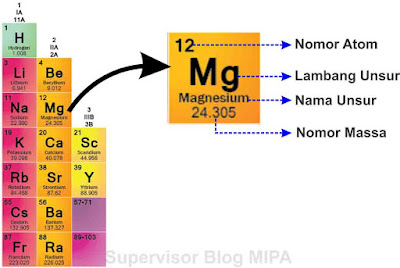
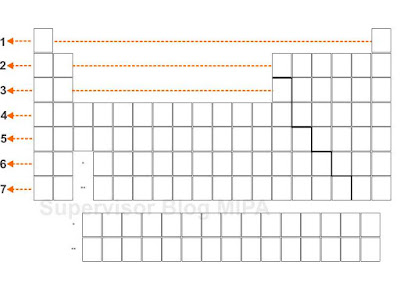
Dalam tabel periodik unsur, setiap cell (kotaknya) terdapat lambang unsur, nomor atom dan nomor massa. Perhatikan gambar berikut
Berdasarkan gambar di atas: Mg adalah lambang unsur Magnesium, memiliki nomor atom 12 dan nomor massa 24.305.
Golongan
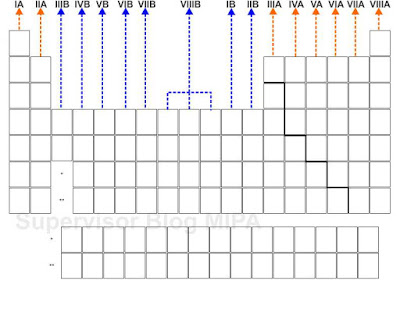
Golongan adalah susunan unsur-unsur kimia dalam sistem periodik unsur ke arah tegak (vertikal). Penentuan golongan berdasarkan kemiripan sifat dimiliki unsur tersebut. Unsur-unsur yang berada dalam satu golongan memiliki sifat-sifat yang mirip. Golongan-golongan dalam sistem periodik unsur antara lain:
1. Golongan IA terdiri dari H, Li, Na, K, Rb,Cs,Fr;
2. Golongan IIA terdiri dari Be, Mg, Ca, Sr, Ba, Ra;
3. Golongan IIIB terdiri dari Sc, Y, deret Lantanida dan Aktinida
4. Golongan IVB terdiri dari Ti, Zr, Hf, Rf;
5. Golongan VB terdiri dari V, Nb, Ta, Db;
6. Golongan VIB terdiri dari Cr, Mo, W, Sg;
7. Golongan VIIB terdiri dari Mn, Tc, Re, Bh;
8. Golongan VIIIB terdiri dari Fe, Ru, Os, Hs, Co, Rh, Ir, Mt, Ni, Pd, Pt, Ds;
9. Golongan IB terdiri dari Cu, Ag, Au, Rg;
10. Golongan IIB terdiri dari Zn, Cd, Hg, Cn;
11. Golongan IIIA terdiri dari B, Al, Ga, In, Ti;
12. Golongan IVA terdiri dari C, Si, Ge, Sn, Pb;
13. Golongan VA terdiri dari N,P, As, Sb, Bi;
14. Golongan VIA terdiri dari O, S,Se,Te, Po;
15. Golongan VIIA terdiri dari F, Cl, Br, I, At;
16. Golongan VIIIA He, Ne, Ar,Kr, Xe Rn;
Periode
Periode adalah susunan unsur-unsur kimia dalam sistem periodik unsur arah mendatar (horizontal). Penentuan periode berdasarkan persamaan jumlah kulit elektron pada unsur-unsur tersebut. Unsur-unsur yang berada dalam satu periode memiliki jumlah kulit elektron yang sama. Golongan-golongan dalam sistem periodik unsur antara lain
- Periode ke-1 : terdiri atas 2 unsur
- Periode ke-2 : terdiri atas 8 unsur
- Periode ke-3 : terdiri atas 8 unsur
- Periode ke-4 : terdiri atas 18 unsur
- Periode ke-5 : terdiri atas 18 unsur
- Periode ke-6 : terdiri atas 32 unsur, yaitu 18 unsur dan 14 unsur lagi merupakan deret lantanida
- Periode ke-7 : terdiri atas 23 unsur (yang belum lengkap). Pada periode ini terdapat deret aktinida.
Unsur Golongan Utama
 |
| Unsur Utama dalam Sistem Periodik Unsur |
1. Golongan IA disebut golongan Alkali (kecuali Hidrogen)
2. Golongan IIA disebut golongan Alkali Tanah
3. Golongan IIIA disebut golongan Boron-luminium
4. Golongan IVA disebut golongan Karbon-Silikon
5. Golongan VA disebut golongan Nitrogen-Fosforus
6. Golongan VIA disebut golongan Kalkogen (oksigen-Belerang)
7. Golongan VIIA disebut golongan Halogen
8. Golongan VIIIA disebut golongan Gas Mulia
Unsur Golongan Transisi
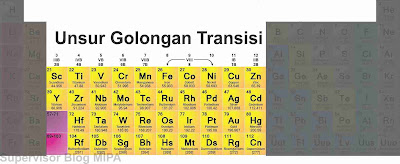 |
| Unsur Transisi dalam Sistem Periodik Unsur |
1. Golongan Transisi (golongan B), yaitu unsur-unsur yang terletak pada golongan IIIB (Sc dan Y), IVB, VB, VIB, VIIB, VIIIB, IB dan IIB
2. Golongan Transisi Dalam, yang terbagi lagi menjadi 2, yaitu:
a. Deret Lantanida (unsur dalam deret ini mempunyai kemiripan sifat dengan unsur 57La)
b. Deret Aktinida (unsur dalam deret ini memiliki kemiripan sifat dengan unsur 89Ac)
Pada periode 6 golongan IIIB terdapat 14 unsur yang sangat mirip sifatnya, yaitu unsur-unsur Lantanida. Demikian juga pada periode 7, yaitu unsur-unsur Aktinida. Supaya tabel tidak terlalu panjang, unsur-unsur tersebut ditempatkan tersendiri pada bagian bawah sistem periodik.



No comments:
Post a Comment