Pengertian, Lambang, Cara Menggambarkan dan Contoh Struktur Lewis
Dalam artikel tentang pengertian, proses pembentukan dan jenis ikatan kimia, telah disebutkan bahwa terbentuknya ikatan kimia dapat terjadi melalui 2 proses, yaitu serah terima elektron dan pemakaian bersama pasangan elektron. Pada saat atom-atom membentuk ikatan kimia, hanya elektron pada kulit terluar yang berperan yaitu elektron valensi.
Elektron valensi yang digunakan untuk membentuk ikatan kimia tersebut digambarkan dalam suatu pola atau diagram yang disebut struktur lewis. Nama Lewis diambil dari penemu struktur bernama Gilbert Newton Lewis seoarang ahli kimia dari Amerika. Lalu apa itu struktur lewis? Untuk menjawab pertanyaan ini silahkan kalian simak baik-baik penjelasan-penjelasan berikut ini.
Pengertian Struktur Lewis
Struktur lewis atau sering disebut rumus lewis adalah suatu pola atau diagram yang menggambarkan jumlah elektron valensi dari atom-atom yang akan membentuk ikatan kimia. Struktur lewis ini berbentuk titik, silang atau bulatan-bulatan yang mengelilingi lambang atomnya, baik atom tunggal maupun atom-atom yang berikatan.
Struktur lewis ini juga dikenal denga rumus atau diagram titik elektron dan ada juga yang menyebutnya diagram titik lewis. Keberadaan struktur lewis ini sangat penting untuk menggambarkan jenis ikatan kimia yang terjadi dalam suatu senyawa serta proses terbentuknya ikatan kimia tersebut. Selain itu, struktur lewis juga dapat digunakan untuk menggambarkan rumus molekul atau senyawa.
Lambang Struktur Lewis
Struktur lewis dapat dilambangkan dengan gambar titik, silang atau bulatan-bulatan kecil, atau bisa juga kombinasi dari titik silang atau bulatan kecil. Satu jenis lambang misalnya titik atau silang biasanya digunakan untuk menggambarkan struktur lewis unsur atau molekul. Lambang kombinasi biasanya digunakan untuk menuliskan ikatan senyawa yang terdiri dari dua atau lebih unsur sehingga akan lebih mudah membedakan elektron valensi masing-masing unsur.
Sedangkan jika menggunakan satu jenis lambang saja, misalnya bulatan, maka dalam menggambarkan ikatan senyawa, bulatan bisa diberi warna yang berbeda untuk membedakan elektron valensi unsur penyusunnya. Berikut ini adalah contoh beberapa lambang lewis dalam unsur, molekul atau senyawa.
1. Lambang Titik
Gambar struktur lewis unsur N
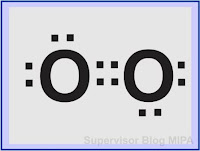
Gambar struktur lewis molekul O2
2. Lambang Silang
Gambar struktur lewis unsur F
Gambar struktur lewis Cl2
3. Lambang Bulatan
Gambar struktur lewis unsur Ne
Gambar struktur lewis H2O
4. Lambang Kombinasi
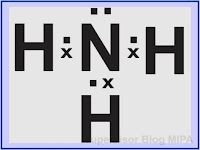
Gambar struktur lewis NH3
Gambar struktur lewis SiF4
Lambang struktur lewis dapat disederhanakan dengan mengganti lambang titik atau silang atau bulatan menjadi sepotong garis. Lambang garis pada struktur lewis ini disebut dengan rumus bangun. Dimana sepotong garis menyatakan sepasang elektron yang digunakan bersama. Perhatikan aturan berikut
5. Lambang Garis
1 garis
|
= 1 pasang elektron ikatan (2 elektron)
|
2 garis
|
= 2 pasang elektron ikatan (4 elektron)
|
3 garis
|
= 3 pasang elektron ikatan (6 elektron)
|
5. Lambang Garis
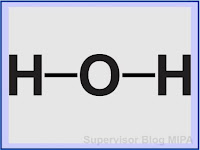
Gambar rumus bangun H2O
Gambar rumus bangun O2
Cara Menggambarkan Struktur Lewis
Untuk bisa menggambarkan struktur lewis suatu molekul atau senyawa, kalian harus mengetahui terlebih dahulu tentang pasang elektron ikatan (PEI) dan pasangan elektron bebas (PEB).
Pasangan elektro ikatan atau PEI adalah pasangan elektron valensi yang dipakai bersama oleh dua atau lebih atom dalam suatu ikatan kimia. Sedangkan pasangan elektron bebas atau PEB adalah pasangan elektron yang tidak terlibat dalam pembentukan ikatan kimia.
|
Berikut ini adalah langkah-langkah sistematis untuk menggambarkan struktur lewis molekul atau senyawa.
1. Tentukan elektron valensi tiap atom dalam molekul
Untuk bisa dengan mudah menentukan elektron valensi atom bisa dilihat dari golongan unsur dalam Tabel Periodik Modern.
2. Jumlahkan semua elektron yang ada pada molekul tersebut
3. Tentukan jumlah pasangan elektron ikatan (PEI)
Nilai PEI ini menunjukkan jumlah ikatan pada molekul. Untuk menghitung PEI, gunakan rumus sebagai berikut:
PEI
|
=
|
Jumlah Total Elektron
|
8
|
Sisa elektron pada perhitungan PEI tidak berpengaruh pada PEI, namun digunakan untuk perhitungan PEB.
4. Tentukan jumlah pasangan elektron bersama (PEB)
Nilai PEI ini menunjukkan jumlah pasangan elektron bebas pada atom pusatnya. Untuk menentukan PEI, gunakan rumus sebagai berikut:
PEB
|
=
|
Jumlah Elektron Sisa pada PEI
|
2
|
Untuk menentukan atom pusat pada struktur lewis suatu molekul atau senyawa dapat digunakan beberapa teknik sebagai berikut:
Cara menentukan atom pusat suatu molekul atau senyawa
1
|
Dalam senyawa, atom yang jumlahnya paling sedikit akan menjadi atom pusat
|
2
|
Jika dalam senyawa terdapat dua atau lebih atom yang jumlahnya sama, maka atom pusat adalah atom yang keelektronegatifannya lebih rendah, atau kalau dalam satu periode posisinya sebelah kiri dari atom lain, bila segolongan yang bertindak sebagai atom pusat ada pada paling bawah.
|
3
|
Atom H dan F tidak pernah berperan sebagai atom pusat. Pada asam oksi (asam yang mengandung oksigen, seperti H2SO4, HNO3, H3PO4, H2CrO4, dan lain-lain) atom H jarang sekali terikat pada atom pusat secara langsung, tetapi H lebih sering terikat pada atom O lebih dahulu).
|
5. Jika ditemui pola yang janggal, bisa disesuaikan dengan kaidah oktet yang paling mungkin
Dalam menentukan struktur lewis suatu senyawa, tidak harus mengikuti kaidah oktet (elektron valensi harus 8) atau kaidah duplet (2 elektron valensi), karena pada beberapa jenis unsur memiliki karakteristik yang berbeda. Untuk itu ada beberapa pengecualian yang harus diperhatikan dalam menggambarkan struktur lewis molekul.
Pengecualian kaidah Oktet-Duplet dalam menggambarkan struktur lewis
1
|
B (boron) maksimal hanya dapat memiliki 6 elektron ketika berikatan
|
2
|
N (nitrogen) pada beberapa jenis senyawa hanya memiliki 7 elektron ketika berikatan
|
3
|
Unsur yang berada pada periode 3 (seperti P, S, Cl, Br, I) dan unsur logam transisi berkemungkinan untuk memiliki elektron lebih dari 8 ketika berikatan
|
Berikut ini adalah contoh cara menggambarkan struktur lewis pada beberapa molekul atau senyawa.
Contoh Cara Menggambarkan Struktur Lewis Suatu Senyawa
1. Cara menentukan struktur lewis senyawa XeO2F2
Tentukan jumlah elektron valensi pada senyawa XeO2F2 yaitu sebagai berikut
Jumlah elektron valensi Xe
|
= 8
| |
Jumlah elektron valensi O2
|
= 2 × 6
|
= 12
|
Jumlah elektron valensi F2
|
= 2 × 7
|
= 14
|
Jumlah total elektron valensi
|
=34
|
Kemudian kita tentukan jumlah PEI dan PEB, dengan rumus yang telah disebutkan di atas,
PEI = 34/8 = 4 sisa 2
PEB = 2/2 = 1
Dari hasil perhitungan PEI dan PEB di atas berarti senyawa XeO2F2 memiliki 4 ikatan dan 1 pasang elektron bebas di atom pusat. Dan yang menjadi atom pusat dari senyawa XeO2F2 adalah Xe karena jumlah atomnya paling sedikit. Kemudian gambarkan struktur lewis XeO2F2 dengan Xe sebagai pusat dengan 1 pasang elektron bebas dan dikelilingi oleh 2 atom O dan F.
Kemudian kita analisis elektron valensi masing-masing atom
Elektron valensi Xe = 8 (sudah oktet)
Jumlah elektron bebas =2, jadi sisa elektron Xe untuk berikatan dengan atom lain adalah 6 elektron
Elektron Valensi F = 7
Untuk mencapai kaidah oktet, maka atom F membutuhkan 1 elektron, sehingga 2 atom F membutuhkan 2 elektron dari Xe. Sisa elektron Xe untuk berikatan adalah 6 – 2 = 4 elektron.
Elektron Valensi O = 6
Untuk mencapai kaidak oktet, maka atom O membutuhkan 2 elektron, sehingga 2 atom O membutuhkan 4 elektron dari Xe. Dan sisa elektron Xe adalah nol.
Pola struktur lewisnya adalah sebagai berikut
PEI Xe = 6 elektron
| |||||
memasangkan
|
memasangkan
| ||||
Xe
|
→
|
1 elektron
|
1 elektron
|
←
|
F
|
PEI Xe = 6 – 1 = 5 elektron
|
PEB F = 7 – 1 = 6 elektron
| ||||
Xe
|
→
|
1 elektron
|
1 elektron
|
←
|
F
|
PEI Xe = 5 – 1 = 4 elektron
|
PEB F = 7 – 1 = 6 elektron
| ||||
Xe
|
→
|
2 elektron
|
2 elektron
|
←
|
O
|
PEI Xe = 4 – 2 = 2 elektron
|
PEB O = 6 – 2 = 4 elektron
| ||||
Xe
|
→
|
2 elektron
|
2 elektron
|
←
|
O
|
PEI Xe = 2 – 2 = 0 elektron
|
PEB O = 6 – 2 = 4 elektron
| ||||
Sehingga gambar struktur lewis untuk senyawa XeO2F2 adalah sebagai berikut:
Struktur lewis XeO2F2 apabila disederhanakan dengan rumus bangun lewis adalah sebagai berikut
2. Cara menentukan struktur lewis senyawa SO3
Tentukan jumlah elektron valensi pada senyawa SO3 yaitu sebagai berikut
Jumlah elektron valensi S
|
= 6
| |
Jumlah elektron valensi O3
|
= 3 × 6
|
= 18
|
Jumlah total elektron valensi
|
=24
|
Kemudian kita tentukan jumlah PEI dan PEB, dengan rumus yang telah disebutkan di atas,
PEI = 24/8 = 3 sisa 0
PEB = 0
Dari hasil perhitungan PEI dan PEB di atas berarti senyawa SO3 memiliki 3 ikatan dan tidak ada pasangan elektron bebas di atom pusat. Dan yang menjadi atom pusat dari senyawa SO3 adalah S karena jumlah atomnya paling sedikit. Kemudian gambarkan struktur lewis SO3 dengan S sebagai pusat dikelilingi oleh 3 atom O.
Kemudian kita analisis elektron valensi masing-masing atom
Elektron valensi S = 6
Karena tidak ada pasangan elektron bebas maka jumlah elektron S untuk berikatan dengan O adalah 6 elektron
Elektron Valensi O = 6
Untuk mencapai kaidah oktet, maka atom O membutuhkan 2 elektron, sehingga 3 atom O membutuhkan 6 elektron dari S. Dan sisa elektron S adalah nol.
Pola struktur lewisnya adalah sebagai berikut
PEI S = 6 elektron
| |||||
memasangkan
|
memasangkan
| ||||
S
|
→
|
2 elektron
|
2 elektron
|
←
|
O
|
PEI S = 6 – 2 = 4 elektron
|
PEB O = 6 – 2 = 4 elektron
| ||||
S
|
→
|
2 elektron
|
2 elektron
|
←
|
O
|
PEI S = 4 – 2 = 2 elektron
|
PEB O = 6 – 2 = 4 elektron
| ||||
S
|
→
|
2 elektron
|
2 elektron
|
←
|
O
|
PEI S = 2 – 2 = 0 elektron
|
PEB O = 6 – 2 = 4 elektron
| ||||
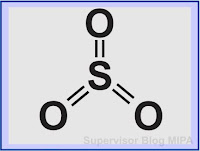
Sehingga gambar struktur lewis untuk senyawa SO3 adalah sebagai berikut:
Struktur lewis SO3 apabila disederhanakan dengan rumus bangun lewis adalah sebagai berikut














No comments:
Post a Comment